
(来源:找药宝典)
6月21日消息 CT-3505胶囊在ALK阳性非小细胞肺癌患者中进行的I期开放、剂量递增及扩展研究,主要目标人群为ALK阳性的非小细胞肺癌。
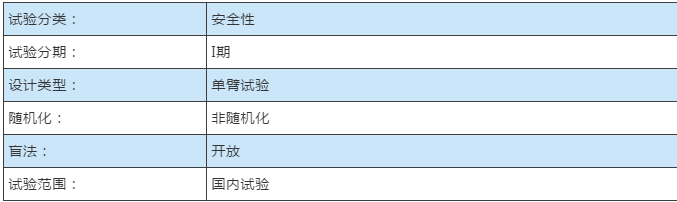
据悉,在ALK阳性NSCLC中考察CT-3505的安全性及耐受性,确定剂量限制性毒性(DLT)、最大耐受剂量(MTD)及II期临床试验推荐剂量(RP2D)。次要目的:考察CT-3505在ALK阳性NSCLC中单剂量和连续服药的药代动力学(PK)特征;初步评价 CT-3505对患者的临床有效性。
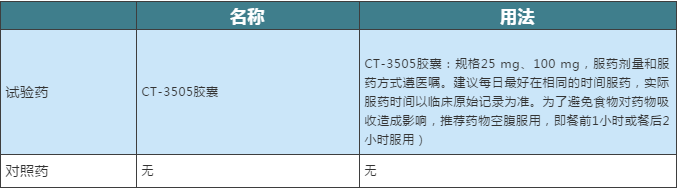
据了解,本次征集患者入选标准为:年龄≥18周岁; 性别:男女不限;
ECOG PS评分为 0~1分;预计生存期不少于12周;根据RECIST V1.1,受试者至少存在一个既往未经过局部治疗的可测量病灶[接受经局部治疗后出现明确疾病进展的可测量病灶;不接受仅骨转移作为可测量病灶;
剂量爬坡阶段入组经组织学或细胞学确诊的ALK阳性非小细胞肺癌患者,剂量扩展阶段入组经过1种或2种 ALK抑制剂治疗的ALK阳性非小细胞肺癌患者。病理报告的要求:接受既往FISH、Ventana IHC和RT-PCR的ALK阳性报告,并尽可能提供组织进行ALK复测;若无既往报告,必须提供组织进行ALK FISH、Ventana IHC或RT-PCR检测。
另据了解,首次给药前3个月内有以下情况者:脑血管意外/卒中、心肌梗死、重度/不稳定型心绞痛、充血性心力衰竭(纽约心脏病协会分类 ≥ II类)、二度或三度房室传导阻滞(除非有起搏器)或任何房室传导阻滞伴 PR间期 >220 msec;或任何等级未控制的心房纤维颤动; ECG检查发现QTcF男性> 450 msec,女性>470 msec,或先天性长 QT 综合征; ≥3级的外周神经疾病(CTCAE 5.0版)有任何活动性自身免疫性疾病或自身免疫性疾病病史需要长期使用类固醇激素或其他免疫抑制剂;
既往间质性肺病史、药物性间质性肺病史、需要类固醇治疗的放射性肺炎史,或任何临床上活动性间质性肺病的迹象;
胃肠道功能障碍或有可能会影响药物吸收的胃肠道疾病(例如CTCAE ≥2级的溃疡性疾病、不能控制的恶心、呕吐、腹泻或不良吸收综合症);
7) 正接受任何抗凝剂治疗、有出血倾向或有凝血障碍的患者;

2022-05-23

2022-05-23

2022-05-23

2022-05-23

2022-05-22
2022-05-21
2022-05-20

2022-05-20

2022-05-20

2022-05-20
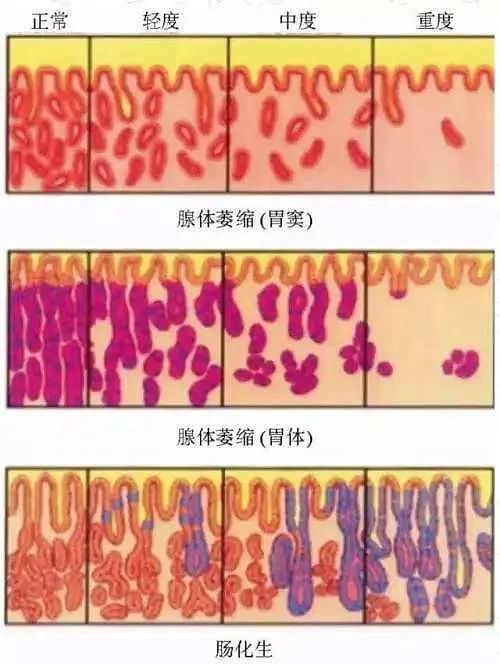
2022-05-20

2022-05-20

2022-05-20
2022-05-20

2022-05-20

2022-05-20

2022-05-20

2022-05-20

2022-05-20

2022-05-20

2022-05-19

2022-05-19

2022-05-19

2022-05-18

2022-05-18